Oxalato
El oxalato (o etanedioato), es el dianión de fórmula C2O42-, que también se escribe (COO)22-. El nombre "oxalato" se utiliza a menudo para los derivados, como el oxalato disódico (Na+)2C2O42-, o los ésteres del ácido oxálico (como el oxalato de dimetilo, (CH3)2C2O4 ). Los oxalatos también forman compuestos de coordinación, que a veces se abrevian como ox. Muchos iones metálicos forman precipitados insolubles con el oxalato, siendo un ejemplo destacado el oxalato de calcio, que es el componente principal de la clase más común de cálculo renal.
RELACIÓN ENTRE OXALATOS Y ÁCIDO OXÁLICO
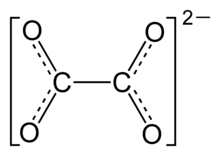 |
A veces queda poco claro en los escritos la distinción entre H2C2O4, HC2O4-, y C2O42-, refiriéndose al conjunto de estas especies como ácido oxálico.
USOS DE LOS OXALATOS
El oxalato (la base conjugada del ácido oxálico) es un excelente ligando para los metales. Por lo general, se une como un ligando bidentado que forma un anillo con cinco miembros MO2C2. Un complejo ilustrativo es el ferrioxalato potásico: K3[Fe(C2O4)3].
El medicamento oxaliplatino mejora la solubilidad en agua en relación con fármacos más antiguos basados en el platino, evitando que se produzcan efectos secundarios de nefrotoxicidad a dosis limitantes.
Debido a que el calcio juega un importante papel en la coagulación de la sangre, el oxalato cálcico se utiliza a veces como método en los laboratorios para evitar la coagulación de las muestras de sangre
El ácido oxálico y los oxalatos pueden ser oxidados por el permanganato en una reacción autocatalítica.
Una de las principales aplicaciones del ácido oxálico es la eliminación de óxido, debido a que las formas de oxalato solubles en agua se unen al ión férrico.
RIESGOS DEL CONSUMO DE OXALATO
Aunque es inusual, el consumo de oxalatos (por ejemplo, el pastoreo de los animales en plantas que contienen oxalato, como las del género Sarcobatus, o el consumo humano de plantas del género Oxalis) puede resultar en enfermedad renal o incluso en la muerte por envenenamiento con oxalato. La presencia de la bacteria Oxalobacter formigenes en la flora intestinal puede evitar este envenenamiento.
El cadmio (Cd) cataliza la transformación de la vitamina C en ácido oxálico. La ingestión excesiva de cadmio puede producirse por fumar en exceso, ingerir productos contaminados con este elemento, o por exposición industrial.
Puesto que el oxalato se combina con cationes como el calcio (Ca2+), hierro (Fe2+) y magnesio (Mg2+), se acumulan en el cuerpo los cristales de oxalato correspondientes, que, por su forma, irritan los intestinos y los riñones. Debido a que los oxalatos se enlazan a elementos importantes como el calcio, una dieta con una gran cantidad de oxalatos puede causar problemas de salud.
Una persona sana puede comer alimentos con oxalatos en cantidades moderadas, pero las personas con enfermedades renales, gota, o artritis reumatoide, deben evitar los alimentos con alto contenido de oxalato. Los cristales de oxalato de calcio, comúnmente conocidos como "piedras en el riñón", obstruyen los conductos de los riñones. Se cree que el 80% de los cálculos renales están formados por oxalato de calcio.
Del mismo modo, comer alimentos con una gran cantidad de calcio, junto con alimentos que contienen oxalato, produce la precipitación de oxalato de calcio en el tracto digestivo, reduciendo los ingresos de oxalato en el cuerpo en un 97%.
ANÁLISIS DE OXALATOS
Métodos de detección
La solución de oxalato se mezcla con una solución tampón de ácido acético/acetato, con un rango de pH entre 4 y 6, y luego se añade una solución de cloruro de calcio. Puesto que otros iones también forman un precipitado blanco, se filtra el precipitado y se disuelve en ácido sulfúrico, se pone una gota de permanganato potásico y se calienta la muestra. Al calentar, la solución de permanganato potásico (de color violeta) se va decolorando.
Determinación de la cantidad
En solución acuosa, se puede determinar la concentración de iones oxalato mediante una titulación con una solución de permanganato potásico (KMnO4), pero debe calentarse antes el oxalato a 70°C. Durante la titulación, se produce la siguiente reacción:
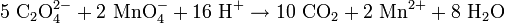
Los oxalatos se descomponen cuando se calientan, pero los productos pueden ser diferentes dependiendo del metal y las condiciones:
- Metales activos
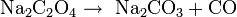
- Metales inactivos